Herzlich willkommen auf Ihrem GPK-Fachportal – kompetente Beratung rund um Arzneimittelversorgung und sicheren Impfstoffversand
Seit 20 Jahren stehen wir für innovative Dienstleistungen und Beratung im Gesundheitsdienst, mit besonderem Beratungsfokus auf die zuverlässige Versorgung und Lieferung von Impfstoffen, Arzneimitteln und Medizinprodukten sowie dem bundesweiten temperaturüberwachten Impfstoffversand unter strikter Einhaltung der Kühlkette. Unser Ziel ist es, die Arbeits- und Betriebsmedizin mit qualitativ hochwertigem Content und praktischen Lösungen zu unterstützen – für mehr Effektivität, Wissen und Erfolg in Ihrer täglichen Arbeit.
Profitieren Sie von den Möglichkeiten bei Ihrer GPK
DIE GPK INFORMIERT: Aktuelles zu Impfstoffen & mehr
Anzeige

Jetzt anmelden: Healthy Work Summit 2026
Der Healthy Work Summit findet am 07. bis 08. Mai 2026 in der Stadthalle Oberursel statt – erneut eine ideale Gelegenheit, Wissen zu erweitern und Impulse und Inspirationen für die Zukunft der eigenen beruflichen Tätigkeit aufzunehmen!
Das innovative Kongress- und Weiterbildungsformat hat sich zur weiteren Entwicklung und Gestaltung der Arbeitsmedizin und des BGM inzwischenfest etabliert. Es richtet sich an Arbeits- und Betriebsmediziner:innen sowie Expert:innen im Betrieblichen Gesundheitsmanagement. An beiden Tagen erwartet Sie wieder ein abwechslungsreiches Programm mit aktuellen praxisrelevanten Themen und konkreten Umsetzungsempfehlungen.
Nutzen Sie den Rabatt-Code „HWS-2026-GPK“ für die Anmeldung und sparen Sie bei sofortiger Anmeldung 15 %.

IMPRESS: Impfverhalten verstehen, Preparedness steigern
Um wirksame Strategien entwickeln zu können, mit denen mehr Menschen erreicht und vor impfpräventablen Erkrankungen geschützt werden, ist es essentiell zu verstehen, wie viele, welche und warum Menschen sich impfen bzw. nicht impfen lassen.
Im Rahmen des Projekts IMPRESS wird daher ein regelmäßiges Impfakzeptanz-Monitoring für Deutschland etabliert, um die Gründe des (Nicht-)Impfens besser verstehen zu können und Ansatzpunkte zu finden, um die Inanspruchnahme von Impfungen zu erhöhen.

WHO-Empfehlungen: Grippeimpfstoffe 2026/2027 mit neuer Zusammensetzung
In den Grippeimpfstoffen der kommenden Saison werden alle drei Influenzavirusstämme ausgetauscht. Auch die Zusammensetzung zwischen Ei- und Zellkultur-basierten Impfstoffen unterscheidet sich leicht.
Die WHO empfiehlt, dass die trivalenten Grippeimpfstoffe 2026/2027 für die Nordhalbkugel folgende Stämme enthalten:
Impfstoffe auf Eibasis
- A/Missouri/11/2025 (H1N1)pdm09-like virus
- A/Darwin/1454/2025 (H3N2)-like virus
- B/Tokyo/EIS13-175/2025 (B/Victoria lineage)-like virus
Impfstoffe auf Zellkultur-, rekombinanter Protein- oder Nukleinsäurebasis
- A/Missouri/11/2025 (H1N1)pdm09-like virus
- A/Darwin/1415/2025 (H3N2)-like virus
- B/Pennsylvania/14/2025 (B/Victoria lineage)-like virus
Unser Tipp !
Jetzt Impfkampagne 2026/2027 planen und Grippeimpfstoffe sichern! Nutzen Sie die Gelegenheit und bestellen Sie Ihre Grippeimpfstoffe über den B2B-Onlineshop der BergApotheke vor.

Niedersachsen: Neuer Vertrag für Sprechstundenbedarf

Impfung hilft dem Herz zu regenerieren

Milliardenverlust bei Biontech: Gründer gehen von Bord

Weiterentwickelte Impfstoffe bändigen auch Virusmutanten

BGH stärkt Auskunftsrechte bei Impfschäden

Grippeviren haben eine „Achillesferse“

Zecken haben wieder Saison
Wer im Frühling durch Wälder und über Wiesen läuft, sollte auf Zecken achten. Die ersten Fälle von Borreliose sind in diesem Jahr schon gemeldet worden, außerdem eine FSME-Erkrankung in Baden-Württemberg. Zudem kommen immer mehr Risikogebiete hinzu. Das Robert Koch-Institut (RKI) hat mit Stand Januar 2026 bundesweit 185 Stadt- und Landkreise als FSME-Risikogebiete ausgewiesen.
Unser Tipp !
Passende FSME-Impfstoffe finden Sie im B2B-Onlineshop unseres Kooprerationspartners BergApotheke. Weitere aktuelle wichtige Informationen Rund um das Thema FSME-Risikogebiete finden Sie auch in unserer Rubrik FSME-Risikogebiete.

Newcastle-Krankheit breitet sich wieder aus

Welt-HPV-Tag: Früh impfen schützt vor Krebs
Obwohl die Infektion meist unbemerkt bleibt und oft von selbst abheilt, kann sie schwerwiegende Langzeitfolgen nach sich ziehen. So erkranken jedes Jahr mehr als 10.000 Menschen an Krebs infolge einer HPV-Infektion, schätzt das Robert Koch-Institut. Dabei ließe sich in Zukunft ein Großteil dieser Erkrankungen vermeiden. Eine Impfung im Kindes- und Jugendalter kann eine spätere Infektion mit den HPV-Typen verhindern, die am häufigsten zu Krebs führen. Anlässlich des Welt‑HPV‑Tages am 4. März weist das Bundesinstitut für Öffentliche Gesundheit (BIÖG) auf die Bedeutung der frühen Impfung hin.

Impfmythen halten sich hartnäckig
Warum sich unser Immunsystem über Jahrzehnte an Impfungen erinnert

WHO präqualifiziert neuen oralen Polio-Impfstoff

Erster Kombiimpfstoff gegen Covid und Grippe kommt

Melioidose: globale Ausbreitung, aber Impfstoff in Sicht

Geänderte Modalitäten der Covid 19 Impfstoffbestellung

Impfung gegen Kokainsucht? Forschung macht Fortschritte

Neue Karte der FSME-Risikogebiete
Unser Tipp !
Weitere aktuelle wichtige Informationen Rund um das Thema FSME-Risikogebiete finden Sie auch in unserer Rubrik FSME-Risikogebiete.

Mehr FSME durch Klimakrise und aktive Zecken

ASS i.v.: Markteinführung des deutschen Produkts für 2027 geplant

USA: Fast 1000 erfasste Masernfälle seit Anfang des Jahres

Nasenspray schützt Mäuse vor Vielzahl von Infektionen

HPV-Impfung schützt nachhaltig vor Gebärmutterhalskrebs

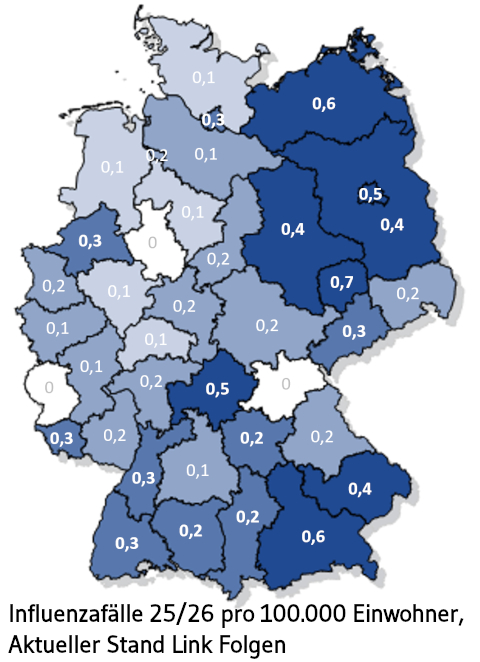
Höhepunkt der Grippewelle ist überschritten

Beschluss in Kraft: Impfung gegen Meningokokken jetzt ab 12

Barmer-Arzneimittelreport verzeichnet Impfquotenrückgang

Chikungunya für Europa problematischer als gedacht

Transplantationspatienten sollten Impfungen im Blick haben

Risikofaktoren für schweren Dengue-Verlauf identifiziert

STIKO@rki – die Impf-App für Ärzt:innen und medizinisches Fachpersonal
Die STIKO@rki-App wurde für die impfende Ärzteschaft und Fachpersonal im Gesundheitswesen entwickelt, um sie bei Fragen zum Impfen im Praxisalltag zu unterstützen. Mit wenigen Klicks bekommen Nutzer:innen die für die Beratung der einzelnen Patient:innen relevanten Informationen.
Abrufbar in der App sind u.a. die Fachinformationen aller Impfstoffe, Antworten auf häufig gestellte Fragen zu Impfungen sowie die RKI-Ratgeber zu impfpräventablen Erkrankungen.
Zusätzlich gibt es weiterhin eine Web-Version der App unter www.STIKO-web-app.de, die sich im Praxisalltag besonders gut direkt am PC nutzen lässt.

Thrombose-Mechanismus nach Corona-Impfung entschlüsselt

Impfauffrischung über die Nase könnte Vorteile haben

Covid-19-mRNA-Impfstoff der nächsten Generation kommt

Vimkunya erneut mit französischer Beschriftung verfügbar

Meningokokken: Das Wichtigste zu Symptomen, Therapie und Impfung

Hohe Hospitalisierungsrate bei Kindern in den USA

G-BA folgt STIKO-Empfehlung zur Herpes-Zoster-Impfung

Influenza-Impfstoff Influvac mit italienischer Beschriftung in Deutschland verfügbar

Bewusstsein für FSME-Risiko ist ausbaufähig
Fast jeder Vierte weiß nicht, ob er in einem FSME-Risikogebiet lebt. Dabei gilt für die entsprechenden Landkreise eine Impfempfehlung, wenn man gegenüber Zecken exponiert ist. Ebenso machen sich viele keine Gedanken um die FSME-Impfung, wenn es um Freizeit und Urlaub geht, zeigt eine Umfrage.
Unser Tipp !
Passende FSME-Impfstoffe finden Sie im B2B-Onlineshop unseres Kooprerationspartners BergApotheke. Weitere aktuelle wichtige Informationen Rund um das Thema FSME-Risikogebiete finden Sie auch in unserer Rubrik FSME-Risikogebiete.

Masern: Darum wird sich das hoch ansteckende Virus weiter ausbreiten

Alfason® heißt jetzt Locobase® – bewährte Pflege, neuer Name

Real-World-Daten stützen STIKO-Empfehlung für Neugeborenenschutz mit Nirsevimab

RSV: Zulassungserweiterung für „Arexvy“

MERS-Impfstoff zeigt gute Wirksamkeit

Das ECDC und die WHO-Europa erneuern Zusammenarbeit

Intravenöses ASS aus Frankreich
Was man über Tuberkulose wissen sollte
Unser Tipp !
Der häufigste Erreger der Tuberkulose beim Menschen ist Mycobacterium tuberculosis. Um eine Infektion mit dem Bakterium festzustellen empfehlen wir den Tuberkulose-Test Tuberkulin PPD RT23, der im B2B-Onlineshop der BergApotheke erhältlich ist. Für eine richtige Interpretation des Tuberkulose-Tests ist es wichtig, dass die Tuberkulinlösung korrekt injiziert wird. Eine detaillierte Beschreibung zur intradermalen Injektion des Tuberkulins finden Sie hier.

Gürtelroseimpfung verlangsamt biologisches Altern

EMA empfiehlt „EURneffy“ nun auch für leichtere Kinder

Kein erhöhtes Risiko für Frühgeburt durch RSV-Impfung
Der in den USA und der Europäischen Union für die Impfung Schwangerer zugelassene RSV-Impfstoff Abrysvo ist nicht mit einem erhöhten Risiko für Frühgeburten assoziiert. Zu dieser Sicherheitsfrage in der Anwendung der Vakzine gab es bislang noch wenig Daten.
Die Interimsanalyse einer großen, retrospektiven Kohortenstudie gibt bei der Frage nach einem erhöhten Frühgeburtsrisiko erst einmal Entwarnung (doi:10.1001/jama.2025.23452). Auch Bluthochdruck war bei den Müttern nach RSV-Impfung in der Schwangerschaft nicht häufiger als bei nicht geimpften Schwangeren einer gematchten Kontrollgruppe. Die neuen Daten gelten als wichtige Ergänzung zur Frage, ob die erst 2023 für Schwangere zugelassene RSV-Vakzine sicher ist.

Was steckt hinter den Warnungen vor „Turbokrebs“?

Kala-Azar endet unbehandelt meist tödlich

Indien meldet zwei Nipah-Virusinfektionen

Impfstoffe gegen Akne in Sicht
Barrierefreiheit auf GPK.de
Wir legen großen Wert darauf, dass unsere Inhalte für alle Menschen erreichbar sind – unabhängig von Alter, Gerät oder individuellen Beeinträchtigungen. Daher haben wir einige Neuerungen umgesetzt, um die GPK-Homepage gut und einfach nutzbar machen.
- Struktur und Semantik: Wir verwenden klare Überschriftenhierarchien, sinnvolle Listenstrukturen und beschreibende Linktexte, damit Screenreader die Seite sinnvoll erfassen können.
- Tastaturzugänglichkeit: Die wichtigsten Funktionen (u.a. Menu und Suchfunktion) sind per Tastatur erreichbar.
- Beschreibende Alternativtexte: Bilder verfügen über aussagekräftige Alt-Texte, damit Inhalte auch ohne visuelle Details verständlich sind.
- Fokusmanagement: Sichtbare Fokus-Stile helfen Nutzenden, sich schnell auf der Seite zurechtzufinden.
- Overlay-Plugin: Wir setzen das Overlay-Plugin OneTap ein, um zusätzliche Hilfselemente wie Sichtbarkeits- und Kontrasteinstellungen, sowie Schriftgrößen-Anpassungen schnell zugänglich zu machen.
- Information zur Barrierefreiheit: Ab sofort finden Sie im Footer einen Link zu unserer „Information zur Barrierefreiheit“, dort finden Sie weitere Hinweise zur Barrierefreiheit und zum aktuellen Status-Quo.
Wir arbeiten kontinuierlich an der Verbesserung der Zugänglichkeit und planen regelmäßige Updates, um neue Inhalte barrierefrei bereitzustellen. Sind Ihnen noch Barrieren beim Zugang zu unseren Inhalten aufgefallen? Dann können Sie sich gerne bei uns melden. Wir freuen uns auf Ihr Feedback an barrieren@gpk.de.

Erstmals Vogelgrippe bei Kuh in den Niederlanden
CSL Seqirus übernimmt Vermarktung von „Dukoral“ und „Ixiaro“

RSV-Welle? Infektionszahlen steigen an

Veröffentlichung des HPV-Impfkonzepts der NaLI und des geplanten HPV-Impfjahres 2028
Auf ihrer Sitzung am 25. November hat die NaLI das gemeinsam erarbeitete „Nationale Konzept zur Förderung der Impfaufklärung und der HPV‑Impfquoten“ verabschiedet. Das Konzept formuliert Ziele und gibt Empfehlungen, um den Schutz der Bevölkerung vor HPV-bedingten Krebserkrankungen weiter zu verbessern. Im Mittelpunkt stehen dabei die Erhöhung der Impfbereitschaft durch Aufklärung über humane Papillomviren (HPV) und die HPV-Impfung, der Ausbau des Impfangebotes sowie die Unterstützung des Gesundheitswesens. Zudem sieht das Konzept die Weiterentwicklung von Surveillance-Instrumenten in Bezug auf die Impfung und HPV-bedingte Erkrankungen vor.

Corona-Impfopfer? Klage gegen AstraZeneca abgewiesen

Impfempfehlungen der STIKO 2026 veröffentlicht
Impfungen gehören zu den wirksamsten und wichtigsten medizinischen Maßnahmen. Die Ständige Impfkommission hat im Epidemiologischen Bulletin KW 04/2026 ihre Empfehlungen und den Impfkalender für 2026 veröffentlicht. Die wesentlichen inhaltlichen Änderungen wurden bereits im Vorfeld veröffentlicht, sie betreffen u.a. die RSV-Impfung für Ältere sowie die Herpes-zoster-Indikationsimpfung und die Chikungunya-Impfung für Reisende.

Polio „bleibt eine Bedrohung, solange es irgendwo auf der Welt existiert“

Hausärzte kritisieren Bestellregelung für Grippeimpfstoffe

Fortschritt für effektive pulmonale mRNA-Impfstoffe

Eine Impfung gegen Kniearthrose?
Rotaviren: Infektionsfälle in Deutschland steigen

Vertrauen schlägt Impfskepsis

Keuchhusten: Impfung der Mutter schützt Neugeborenes